de Katie Perryman, Ed Sylvester et Brad Buecker, ChemTreat, Inc.
Cet article a été initialement publié dans The Analyst, une publication de l’AWT.
L’eau de haute pureté est généralement indispensable pour les générateurs de vapeur produisant de l’énergie, car les conditions de haute température et de haute pression exigent le contrôle des impuretés à de faibles concentrations en parties par milliard (ppb) pour éviter une corrosion et un encrassement importants. Cependant, pour les milliers de chaudières à basse pression des installations industrielles du pays, les exigences en matière de pureté de l’eau ne sont généralement pas aussi strictes. Pourtant, des incidents où une mauvaise conception ou des défaillances du système de traitement de l’eau d’appoint ont provoqué un entartrage et une corrosion graves ont été enregistrés depuis des décennies et continuent de se produire. Cela peut entraîner une perte de production et des réparations ou des remplacements d’équipements coûteux. Cet article donne un aperçu de l’importance du traitement de l’eau d’appoint pour les chaudières à basse pression et présente les technologies modernes permettant de produire une eau d’appoint de bonne qualité à un coût raisonnable.
Générateurs de vapeur à basse pression
La vapeur à basse pression (pressions inférieures à 900 livres par pouce carré jauge [psig] en général, et souvent entre 50 et 600 psig) est utilisée dans de nombreuses installations industrielles du pays. Par exemple, la vapeur sert généralement à de nombreux procédés dans les raffineries, notamment comme source de chaleur intégrale dans la distillation atmosphérique et dans les procédés de craquage et de reformage. La vapeur alimente des turbines pour la production d’air de haut fourneau dans les aciéries intégrées, des lessiveurs et des concentrateurs dans les papeteries, des évaporateurs, des cristalliseurs et des cuves de réaction dans les usines chimiques, ainsi que des systèmes de chauffage de bâtiments partout dans le monde. La liste est longue.
L’idée de cet article vient de l’expérience directe des auteurs et des rapports trop fréquents de nos collègues qui, lorsqu’ils entrent dans une usine pour la première fois, trouvent des générateurs de vapeur présentant de graves problèmes d’entartrage, de corrosion ou de pureté de la vapeur qui peuvent être directement attribués à une mauvaise conception ou à une attention insuffisante du système d’eau d’appoint (et souvent de la chimie du retour des condensats). Cela semble souvent être le résultat du fait que le gestionnaire de l’usine, les opérateurs ou le personnel technique se concentrent sur la chimie et l’ingénierie des procédés, la production de vapeur (et les systèmes d’eau de refroidissement) apparaissant comme des entités plutôt nébuleuses qui nécessitent moins d’attention.
La plupart des chaudières des grandes installations industrielles sont du type à tubes d’eau, souvent de type monobloc, bien que les grandes chaudières puissent être montées sur place. Les taux de vaporisation (livres par heure [lb/h]) se situent généralement dans une fourchette de cinq à six chiffres. Ces chaudières comprennent généralement des surchauffeurs pour élever la température de la vapeur au-dessus du point de saturation et garantir que la vapeur a l’énergie appropriée et/ou reste sèche jusqu’au point d’utilisation. Pour les chaudières qui alimentent des turbines, la surchauffe est nécessaire pour éviter une condensation excessive dans la turbine qui pourrait endommager les aubes.
Problèmes de traitement d’appoint
Probablement depuis que les humains ont commencé à chauffer l’eau pour leurs besoins personnels, notre espèce a observé des dépôts dans les récipients chauffés. Ces questions sont devenues beaucoup plus aiguës après l’invention et l’utilisation accrue de la machine à vapeur pendant la révolution industrielle des 18e et 19e siècles. Le principal coupable était (et est encore souvent) le dépôt de carbonate de calcium.
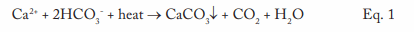
Cette équation décrit la réaction des ions calcium (Ca2+) et de l’alcalinité du bicarbonate (HCO3–) qui peut se produire dans les systèmes d’eau chaude et les chaudières. Un point critique à noter est que le CaCO3 est un sel inversement soluble, dont le potentiel de dépôt augmente avec la température. Comme l’illustre clairement la figure 1, il ne s’agit pas d’un mécanisme relégué dans le passé.

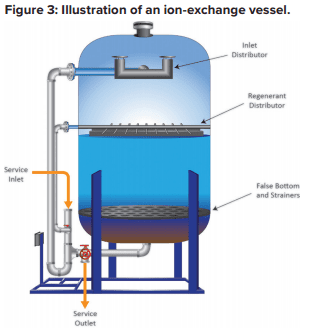
Avec l’augmentation de la pression et de la puissance des générateurs de vapeur au cours du siècle dernier, des méthodes permettant de minimiser et de contrôler l’entartrage par le CaCO3 sont devenues nécessaires. Une solution courante depuis les années 1930 a été l’adoucissement de l’eau par zéolithe de sodium, une technologie qui est devenue pratique avec le développement des résines synthétiques échangeuses d’ions (Figure 2).

Chacune de ces billes contient des milliards de sites actifs qui, pour l’adoucissement du sodium, sont généralement des groupes d’acide sulfonique auxquels est attaché du sodium (SO3–Na+). La figure 3 illustre une configuration de base d’une cuve d’adoucissement.
Lorsque l’eau d’appoint passe dans le vaisseau, le calcium (Ca2+) et le magnésium (Mg2+) s’échangent contre du sodium. L’affinité la plus forte est pour le calcium, suivi du magnésium, de sorte qu’au fur et à mesure qu’un service progresse, la résine développe des couches stratifiées.

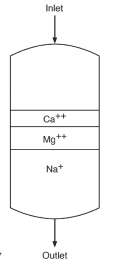
Le flux adouci, dont la dureté a été éliminée, contient encore les autres ions dissous, notamment l’alcalinité, le chlorure (Cl–), le sulfate (SO42-) et la silice (SiO2). Lorsque le lit est épuisé, il est régénéré à l’aide d’une solution de saumure qui chasse les ions de dureté dans un flux de déchets, qui est mis au rebut.
À ce stade, plusieurs caractéristiques de l’adoucissement au sodium nécessitent une discussion supplémentaire. De nombreux systèmes de générateurs de vapeur à basse pression ont été conçus avec l’adoucissement au sodium comme méthode de traitement de base de l’appoint de la chaudière, sans autre traitement. Et en effet, cela peut être suffisant pour de nombreux générateurs de vapeur. Le Tableau A présente quelques directives générales, extraites d’une source bien connue de l’American Society of Mechanical Engineers (ASME), concernant les limites d’impuretés dans les chaudières industrielles à tubes d’eau à basse et moyenne pression.
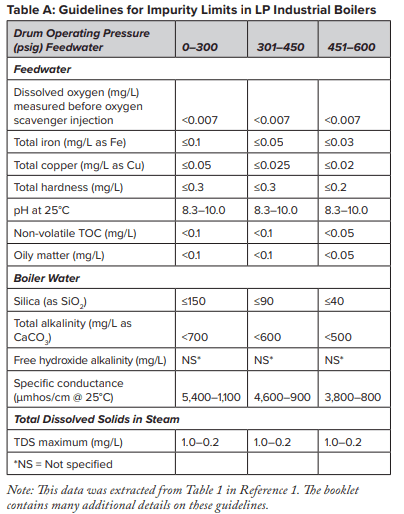
Les données indiquent qu’une quantité significative d’alcalinité peut être tolérée dans les chaudières à basse pression, et pour de nombreuses applications, une certaine alcalinité peut être souhaitable, car elle aide à protéger les surfaces métalliques de la corrosion, un point sur lequel nous reviendrons plus tard. Cependant, le HCO3, lorsqu’il atteint la chaudière, est en grande partie converti en CO2 par les réactions suivantes des équations 2 à 4.
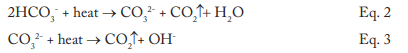
La conversion en dioxyde de carbone (CO2) des réactions combinées peut atteindre 90 %. CO2 clignote avec la vapeur, et quand le CO2 se dissout à nouveau dans le condensat, il peut augmenter l’acidité du condensat retourné.
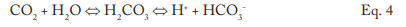
Bien que le pH généré par cette réaction ait une limite inférieure relativement douce, l’acidité est plus que suffisante pour provoquer une corrosion importante de l’acier au carbone dans les systèmes de retour du condensat. Par exemple, 3 parties par million (ppm) de CO2 dans un condensat de vapeur pure abaisseront le pH à 5,26. Si de l’oxygène dissous est présent dans le système, la corrosion peut être fortement amplifiée.
Le fonctionnement d’une unité qui peut minimiser la production de CO2 dans le générateur de vapeur est illustré dans le schéma fondamental suivant.
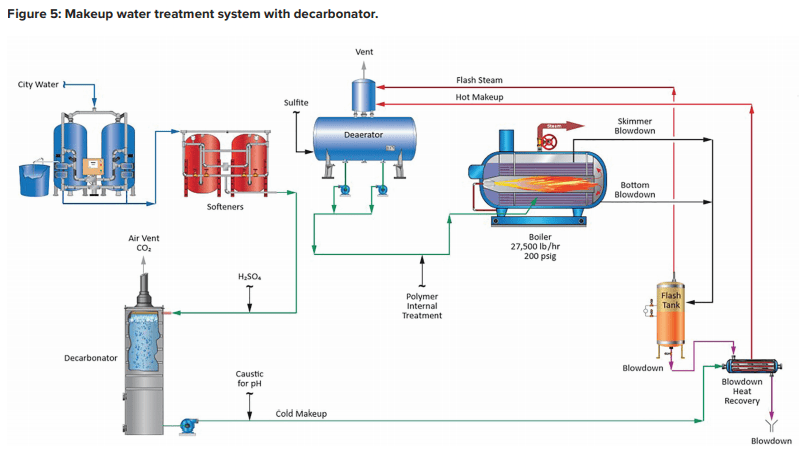
Notez l’inclusion d’un décarbonateur à tirage forcé avec injection d’acide dans l’alimentation. Le conditionnement acide force l’équation 4 vers la gauche, et un décarbonateur bien conçu peut réduire la concentration de CO2 à un faible niveau de parties par million (ppm). L’alimentation en caustique en aval du décarbonateur augmente ensuite le pH de l’eau pour la rendre moins corrosive sur son chemin vers la chaudière. Remarque : Si l’atténuation de la vapeur est assurée par l’injection directe de l’eau d’alimentation provenant du dégazeur, il n’est pas possible d’utiliser du caustique pour augmenter le pH. Un composé non volatil (par exemple, l’ammoniac, une amine) est nécessaire.
Une autre question, brièvement évoquée plus haut, nécessite une discussion plus approfondie. Avec une régularité trop fréquente, lorsque les représentants techniques commencent à visiter une usine pour la première fois, ils trouvent des chaudières présentant des dépôts de calcaire, de la corrosion, ou les deux. Dans de nombreux cas, le personnel de l’usine révélera des problèmes d’adoucisseur qui ont conduit à des avancées en matière de dureté. L’équation 1 et la figure 2 illustrent les effets potentiels de ces difficultés. Mais même un adoucisseur/décarbonateur fonctionnant correctement permet à de nombreux ions, tels que le chlorure et le sulfate, d’entrer dans la chaudière. Si l’on ne porte pas une attention particulière à la chimie de l’eau des chaudières et au contrôle de la vidange sous pression des chaudières, l’accumulation de ces ions peut provoquer de la corrosion et d’autres problèmes, notamment la formation de mousse dans les fûts de la chaudière. Cela peut à son tour entraîner une contamination de la vapeur et des problèmes en aval. Pour insister à nouveau, le contrôle du système d’appoint des générateurs de vapeur et de la chimie de l’eau des chaudières requiert autant d’attention que les opérations de traitement.
Quelque chose de mieux que l’adoucissement?
Pour les systèmes d’adoucissement modernes, l’osmose inverse (OI) offre une alternative fiable à l’adoucissement, car même les systèmes de base peuvent éliminer plus de 99 % de tous les ions de l’eau. Le processus d’osmose est connu depuis des années. Deux solutions de concentrations différentes, lorsqu’elles sont séparées par une membrane semi-perméable qui ne laisse passer que l’eau, vont inciter l’eau de la solution diluée à traverser la membrane vers l’autre solution pour équilibrer la concentration. Ce phénomène induit une pression osmotique sur la membrane jusqu’à ce que les solutions atteignent l’équilibre. Comme le nom d’osmose inverse l’indique, la réaction s’effectue en sens inverse et la pression produit de l’eau purifiée à partir d’un flux plus concentré.
L’application potentielle de l’osmose inverse en tant que méthode de traitement de l’eau d’appoint est devenue bien connue au siècle dernier et est devenue populaire avec le développement et les améliorations de la technologie des membranes enroulées en spirale.
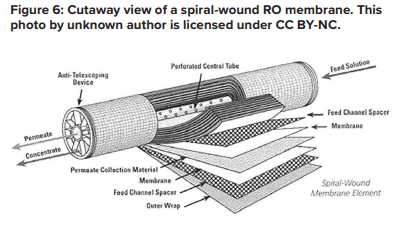
Une feuille de membrane plate est constituée de plusieurs couches qui servent d’épine dorsale et qui sont toutes enroulées autour d’un noyau central en plastique perforé. L’alimentation pénètre dans l’extrémité avant de chaque élément et s’écoule le long du support d’eau d’alimentation, tandis que la pression pousse l’eau à travers la membrane. L’eau purifiée, connue sous le nom de perméat, s’écoule vers le noyau central et l’eau d’alimentation de plus en plus concentrée (décharge) sort de l’élément.
Chaque récipient à pression d’osmose inverse comporte généralement plusieurs éléments disposés en série.
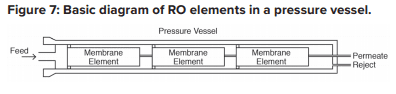
Des joints toriques assurent l’étanchéité de chaque élément le long des parois de la cuve sous pression afin que l’eau d’alimentation ne court-circuite aucun des éléments. Un récipient sous pression d’OI typique comporte cinq ou six éléments.
La configuration est conçue pour traiter l’eau par le biais du mécanisme connu sous le nom de filtration à flux croisé.
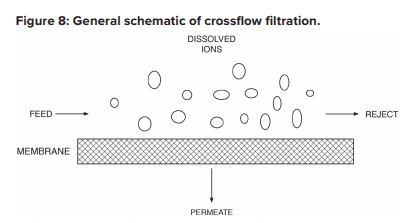
L’alimentation s’écoule parallèlement aux membranes d’OI et la pression force l’eau pure à traverser les membranes tandis que les impuretés sont emportées par le rejet. Seuls quelques-uns des plus petits ions monovalents (Na+, Cl-, silice, HCO3) traversent la membrane. Cependant, bien que la filtration tangentielle soit conçue pour maintenir les impuretés en suspension dans le flux de rejet, il est inévitable que, même avec un appoint exceptionnellement propre, des composés s’accumulent progressivement sur les surfaces de la membrane. En général, les solides en suspension résiduels qui ne sont pas capturés par le prétraitement s’accumulent dans les membranes de plomb d’un système d’OI. À l’inverse, comme les ions dissous se concentrent lorsque l’eau passe d’une membrane à l’autre, l’entartrage devient une préoccupation croissante dans les éléments en aval.
Le système OI de base est de type à deux étages et à un seul passage, comme illustré à la figure 9.
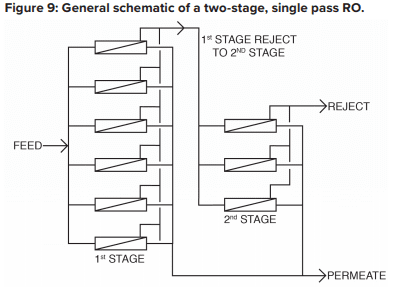
Une caractéristique critique de l’OI est illustrée dans ce diagramme. Avec les eaux d’alimentation « normales », environ 50 % de l’eau d’alimentation est convertie en perméat dans chaque récipient sous pression du premier étage. Cela signifie que sans traitement supplémentaire, 50 % de l’eau d’alimentation serait gaspillée. Dans la conception à deux étages présentée ci-dessus, l’eau d’alimentation brute circule dans six réservoirs sous pression parallèles dans le premier étage, et le rejet de ces réservoirs est acheminé dans trois réservoirs sous pression supplémentaires dans le deuxième étage. La récupération totale de l’eau passe à 75 %.
Pour certaines applications, notamment celles destinées à la production d’eau ultra-pure, l’osmose inverse à deux passages est courante. Dans cette configuration, le perméat du premier passage est traité dans un ensemble séparé de membranes. Comme l’eau d’alimentation a déjà été considérablement purifiée, il est possible d’obtenir une récupération de 85 % à 90 % lors du deuxième passage. Le rejet est recyclé à l’entrée du premier passage, et aucune eau n’est évacuée dans les déchets du second passage.
L’OI est devenue très populaire pour plusieurs applications ces dernières années, notamment pour les unités de production d’électricité à base de vapeur. L’OI plus les échangeurs d’ions à lit mixte de polissage ou l’électrodéionisation peuvent produire l’eau de haute pureté nécessaire à la génération de vapeur
Contrôle de l’encrassement et du tartre dans l’OI
Les membranes OI, en particulier les éléments en plomb, sont sensibles à l’encrassement particulaire. Une mesure importante pour déterminer ce potentiel d’encrassement est l’indice de densité de limon (SDI). Habituellement, des filtres de profondeur de 5 microns (µm) sont placés en amont de l’OI pour réduire au minimum le risque d’encrassement par les particules. Les essais SDI doivent être effectués sur l’effluent de ces filtres. L’essai SDI est simple. Un échantillon de l’eau d’alimentation de l’osmose inverse, en aval des filtres à cartouche, est acheminé à travers un filtre de 0,45-µm à une pression de 30 psig. Le temps de passage de 500 millilitres (mL) d’eau à travers le filtre est mesuré au début du test (ti) et à nouveau après 15 minutes (tf). Le SDI est calculé comme indiqué dans l’équation 5 :

En règle générale, l’IDS doit être au moins inférieur à 5 et de préférence inférieur à 3. Toutefois, le SDI ne doit pas être le seul critère permettant de déterminer l’adéquation d’une application de l’OI. Le type d’eau et/ou la nature des contaminants doivent également être pris en compte. Par exemple, dans une application, les lectures SDI de l’alimentation OI étaient toujours comprises entre 1 et 3. Pourtant, les membranes se sont encrassées de particules d’oxyde de fer exceptionnellement fines.
La formation d’écailles est un autre problème auquel il faut prêter attention. Lorsque l’eau traverse un réservoir sous pression d’OI, le concentré accumule continuellement des solides dissous, ce qui augmente le potentiel d’entartrage. Le carbonate et le sulfate de calcium peuvent s’accumuler jusqu’à un point où les précipitations commencent à se produire. D’autres dépôts possibles comprennent la silice et les silicates de métaux alcalins, le sulfate de strontium, le sulfate de baryum et le fluorure de calcium. Si le prétraitement peut réduire les concentrations de nombreux composés formant le tartre, les autres peuvent encore poser des problèmes. Les écailles de sulfate de baryum et de strontium sont particulièrement difficiles à éliminer. Les fabricants de membranes réputés ont développé des programmes permettant de calculer les limites de solubilité de ces sels. Le programme avertit l’utilisateur si une limite de solubilité est dépassée. Les programmes fournissent également des calculs de « normalisation » du système d’OI, comme cela est décrit plus loin.
L’alimentation en antitartre est typique des systèmes d’OI. Les antitartres courants comprennent les polyacrylates et les phosphonates. Le bon antitartre ou mélange peut contrôler le sulfate de calcium à un facteur de 7 au-dessus de la limite de saturation, le sulfate de strontium à 800 % au-dessus de la limite de saturation et le sulfate de baryum à 6 000 % au-dessus de la limite de saturation.
Les produits chimiques de prétraitement peuvent affecter les performances de la membrane. Les agents coagulants de type cationique et, plus particulièrement, les composés d’aluminium et certains coagulants/floculants organiques, sont particulièrement gênants pour les membranes d’osmose inverse. Si ces agents sont présents, il faut envisager des méthodes pour les éliminer. Le chlore, généralement introduit sous forme d’eau de Javel, injecté dans l’installation primaire pour lutter contre l’encrassement microbiologique, réagira avec les atomes d’azote des membranes d’OI et endommagera irréversiblement les matériaux. Le chlore doit être éliminé en amont de l’OI, mais l’absence de biocides laisse les membranes en danger d’attaque microbienne. La figure 10 montre comment l’encrassement biologique peut endommager un élément de membrane.

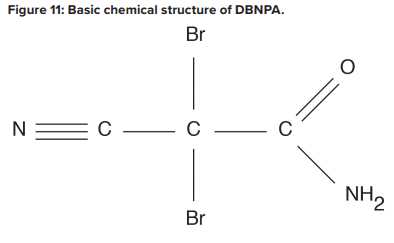
L’encrassement biologique peut causer des dommages irréversibles aux membranes car les dépôts ne peuvent pas être complètement éliminés par les méthodes de nettoyage standard. Il est impératif de minimiser les conditions qui peuvent conduire à un dépôt microbiologique. Il existe des techniques alternatives au chlore pour réduire au minimum le dépôt de microbes dans les membranes. L’une d’elles est le traitement périodique avec un biocide non ou légèrement oxydant (la fréquence dépend du potentiel d’encrassement). Un choix populaire est le dibromo-nitrilo-propionamide (DBNPA). Un diagramme chimique du DBNPA est présenté à la figure 11.
Le DBNPA est un biocide à action rapide qui peut être facilement éliminé de n’importe quelle décharge en augmentant le pH à environ 9 ou, plus communément, en traitant avec du bisulfite de sodium. Une autre possibilité est une version spécialisée du dioxyde de chlore (ClO2).A Un tel produit peut paraître surprenant, car le dioxyde de chlore peut agir comme un oxydant puissant dans les applications d’eau de refroidissement. Cependant, dans ce cas, le chlore n’est pas libre, et ne réagit donc pas avec les atomes d’azote des membranes.
Nettoyage des OI
Même avec un prétraitement et une chimie antitartre bien contrôlés, les membranes d’osmose inverse peuvent accumuler des dépôts. Les éléments en amont recueillent les solides résiduels colloïdaux et en suspension, tandis que les éléments en aval, notamment ceux du deuxième étage, voient des concentrations plus élevées d’ions dissous qui peuvent précipiter. La pression nécessaire pour faire passer l’eau à travers les membranes peut maintenir certaines de ces particules en place, ce qui aggrave le problème. Si les impuretés s’accumulent sans être contrôlées, le résultat final est un encrassement irréversible de la membrane.
Les programmes de normalisation sont donc essentiels pour déterminer la nécessité et le calendrier des nettoyages des OI. La température a une incidence importante sur le flux et la pression du perméat, et les changements de température peuvent masquer les variations de débit et de pression causées par les solides en suspension ou l’accumulation de tartre. Les programmes de normalisation utilisent les mesures de température, de pression et de débit pour fournir des valeurs corrigées pour toutes les conditions de température. Une règle générale consiste à programmer un nettoyage lorsque la valeur normalisée a chuté de 10% à 15% par rapport à la ligne de base. Les programmes de normalisation peuvent également aider à détecter une augmentation du passage du sel causée par une membrane défaillante ou dégradée, qui pourrait autrement être attribuée aux effets de la température.
Un processus de nettoyage en deux étapes est souvent utilisé pour éliminer la grande variété d’impuretés qui peuvent s’accumuler dans les membranes d’OI. Typiquement, dans la première étape, une solution à pH élevé (12à 35 °C (95 °F)) circule dans les membranes. La solution alcaline élimine les composés organiques, microbiologiques et autres, qui se sont accumulés. Cette étape est suivie d’un rinçage et souvent d’une étape à faible pH dont l’acide citrique est l’ingrédient clé. Un pH faible permet d’éliminer les sels minéraux solubles tels que le carbonate de calcium, tandis que l’acide citrique chélate les métaux, notamment le fer. L’inclusion d’un réchauffeur dans la boucle de nettoyage peut accélérer considérablement le processus.
Un concept important consiste à nettoyer chaque étape séparément. Sinon, les impuretés extraites d’une étape peuvent encrasser l’autre, et vice versa. De plus, les systèmes de nettoyage sont généralement conçus avec des filtres à cartouche dans la boucle de nettoyage pour collecter les solides pendant le processus. Ces filtres doivent être remplacés après chaque étape du nettoyage.
Ce qui précède n’est qu’une orientation générale. Veuillez consulter le fabricant de votre OI pour des conseils spécifiques.
Questions relatives au flux de déchets de l'OI
Comme indiqué, un système d’osmose inverse typique à deux étages et à un seul passage récupère environ 75 % de l’alimentation d’entrée et produit un flux de déchets (rejet) du 25 % restant. Ce flux doit être éliminé quelque part. Pour les installations équipées de tours de refroidissement, le bassin d’une des tours est souvent un emplacement idéal pour la décharge. Par ailleurs, de nombreuses usines disposent d’installations de traitement des eaux usées pour conditionner les eaux de décharge avant leur rejet dans l’environnement. Les rejets de l’osmose inverse sont essentiellement des produits d’appoint de l’usine concentrés par un facteur de quatre, de sorte qu’ils ne devraient pas surcharger l’équipement de traitement des eaux usées.
Traitement de l’eau d’appoint – Problèmes liés au traitement d’eau de chaudière
Il existe une variété de programmes de traitement pour les chaudières à basse pression, qui peuvent inclure des phosphates, des polymères organiques et parfois des agents chélatants. Ils doivent être adaptés à la chimie de l’eau qui entre dans la chaudière à partir de la source d’appoint et du retour des condensats. Le passage d’une eau adoucie à un perméat d’OI peut avoir un impact significatif sur le traitement d’eau de chaudière et même sur le traitement de l’eau d’alimentation. Les eaux de haute pureté sont souvent appelées eaux « affamées » car le manque d’ions dissous incite les métaux à céder des ions à l’eau. Les ions bicarbonate, même s’ils peuvent réagir avec le calcium pour former du tartre, forment dans de nombreux cas une couche protectrice lâche sur les métaux. Pour le personnel de l’usine qui envisage de passer de l’eau adoucie à l’osmose inverse, ces facteurs, ainsi que d’autres, doivent être pris en compte avant de faire le changement. Et, étant donné que les chaudières devraient voir un afflux plus faible de dureté, le programme de traitement peut devoir être modifié pour tenir compte de cette chimie modifiée. Dans de nombreuses usines, le rapport entre l’eau d’appoint et le retour des condensats est un facteur très important. Si ce dernier est beaucoup plus élevé que le débit d’appoint, la chimie du retour des condensats peut dominer la sélection du meilleur programme de traitement de l’eau de chaudière.



