-
USA - EnglishCanada – Français
- Emplacements
- Accès aux FDS
- Connexion CTVista®+
Par Brad Buecker et Prasad Kalakodimi, Ph. D.
Cet article a été initialement publié dans le PPCHEM® Journal; PPCHEM® 2021, 23(5), 198–205; https://journal.ppchem.com/
Les échangeurs de chaleur sont, bien sûr, un composant essentiel des usines électriques et industrielles lourdes. Bon nombre d’entre eux sont refroidis à l’eau, la source étant une tour de refroidissement (communément appelée un système de refroidissement ouvert) ou parfois un refroidissement à passage unique. Souvent, des systèmes « fermés » sont également présents, qui sont refroidis par des échangeurs de chaleur primaires, mais dont la chimie est significativement différente de celle des systèmes ouverts. Le traitement chimique réussi de la grande variété de systèmes de refroidissement dans les usines nécessite l’analyse de nombreux facteurs, y compris le potentiel de corrosion, d’entartrage et d’encrassement microbiologique, de métallurgie du système, de températures de fonctionnement et autres, qui sont tous examinés dans cet article. Nous avons également discuté de plusieurs améliorations importantes apportées aux programmes de traitement chimique au cours des dernières années, des améliorations qui maintiennent un transfert de chaleur approprié et la fiabilité des systèmes de refroidissement.
Dans les centrales électriques génératrices de vapeur, l’échangeur de chaleur refroidi à l’eau principal est le condenseur de surface de vapeur, à moins, bien sûr, que l’usine ait un condenseur refroidi à l’air (ACC). Plusieurs autres échangeurs de chaleur sont également présents, y compris le refroidisseur d’huile de lubrification de turbine, l’échangeur de chaleur d’eau de refroidissement des roulements et le refroidisseur d’hydrogène. De nombreux échangeurs de chaleur supplémentaires sont utilisés dans de grandes usines industrielles telles que les raffineries, les usines pétrochimiques, etc. Un large éventail de conceptions est possible : de la coquille et du tube à la plaque et au cadre en passant par les systèmes gainés et autres. Les systèmes de refroidissement peuvent être ouverts ou fermés. Ces arrangements complexes nécessitent généralement une variété de méthodes de traitement. De plus, contrairement aux centrales électriques modernes, où la sélection des matériaux a gravité vers une métallurgie entièrement ferreuse dans le condensat, l’eau d’alimentation/économiseur et les chaudières, plusieurs métaux peuvent être présents dans les systèmes industriels. Les alliages de cuivre sont assez courants comme matériau de tube dans les échangeurs de chaleur à enveloppe et tube.
De nombreux facteurs peuvent influencer la performance et la fiabilité du système de refroidissement et de l’échangeur de chaleur, avec une représentation générale décrite à la figure 1.

Figure 1.Le triangle corrosion-déposition-biosalissure.
Comme le suggère ce diagramme, la corrosion, la formation de tartre et l’encrassement biologique ne sont pas exclusifs individuellement. Le programme de traitement chimique d’une usine doit tenir compte des trois facteurs, et en effet, le triangle pourrait même être élargi pour inclure des questions environnementales [1]. Dans la première partie de cet article, nous nous concentrerons sur les systèmes ouverts, et principalement ceux fournis par les tours de refroidissement.
Un exemple classique de problèmes simultanés peut être vu à la figure 2, qui montre un échangeur de chaleur à tube et à coquille à plusieurs passages, dont l’eau de refroidissement à l’époque a été traitée avec un programme traditionnel à base de phosphate.

Figure 2.Échangeur de chaleur à passages multiples sur un programme de phosphate juste avant un changement de chimie du traitement.
À l’entrée de l’échangeur de chaleur (les tubes au bas de cet appareil), la corrosion était problématique. Du côté de la sortie du réchauffeur (en haut), des dépôts et la formation de tartre se sont produits. Par conséquent, le programme n’a pas été particulièrement efficace pour atténuer la corrosion ou les dépôts selon l’emplacement. Nous reviendrons à cet exemple plus loin dans l’article.
Du point de vue microbiologique, les systèmes de refroidissement offrent un environnement idéal, chaud et humide, pour que les microbes prolifèrent et forment des colonies. Les bactéries peuvent se développer dans les échangeurs de chaleur et le remplissage de la tour de refroidissement, les champignons sur et dans le bois de la tour de refroidissement et les algues sur les composants de la tour de refroidissement mouillés exposés au soleil. Un problème majeur avec les microbes, en particulier certaines bactéries, est qu’une fois qu’ils se déposent sur les surfaces, les organismes sécrètent une couche de polysaccharide (lime) pour la protection. Ce film peut inhiber gravement le transfert de chaleur, et il peut également recueillir le limon de l’eau et s’épaissir, dégradant davantage l’échange de chaleur (voir Figure 3). Les biofilms limitent le transfert de chaleur plus efficacement que presque tout autre dépôt. De plus, un encrassement important peut réduire considérablement le débit de liquide, parfois jusqu’à un blocage complet.

Figure 3. Tubes d’échangeur de chaleur encrassés de microbes et de slime.
Dans un autre clin d’œil à la figure 1, la couche protectrice de slime formée par les dépôts bactériens initiaux permet aux bactéries anaérobies et facultatives en dessous de s’épanouir. Ces organismes peuvent générer des acides et d’autres composés nocifs qui attaquent directement les métaux. Les dépôts microbiens établissent également des cellules de concentration, où le manque d’oxygène sous le dépôt entraîne l’anodicité de ces emplacements dans d’autres zones du métal exposé. La perte de métal se produit aux anodes, avec des piqûres en conséquence (voir Figure 4).

Figure 4.Un grand puits de corrosion sous le dépôt (avec dépôt retiré) dans un tube d’échangeur de chaleur en acier inoxydable.
Bien sûr, un contrôle chimique approprié pour minimiser l’encrassement et l’entartrage est une méthode clé pour aider à maintenir la fiabilité et la performance de l’échangeur de chaleur, comme nous l’examinerons plus tard, mais l’un des avantages de la conception de la coque et du tube par rapport aux autres est la capacité, dans de nombreux cas, à éliminer les dépôts visqueux et certains composés de dureté par nettoyage mécanique. Le nettoyage mécanique d’autres échangeurs de chaleur, par exemple des unités de plaque et de cadre (Figures 5a b), peut être beaucoup plus difficile, voire impossible.
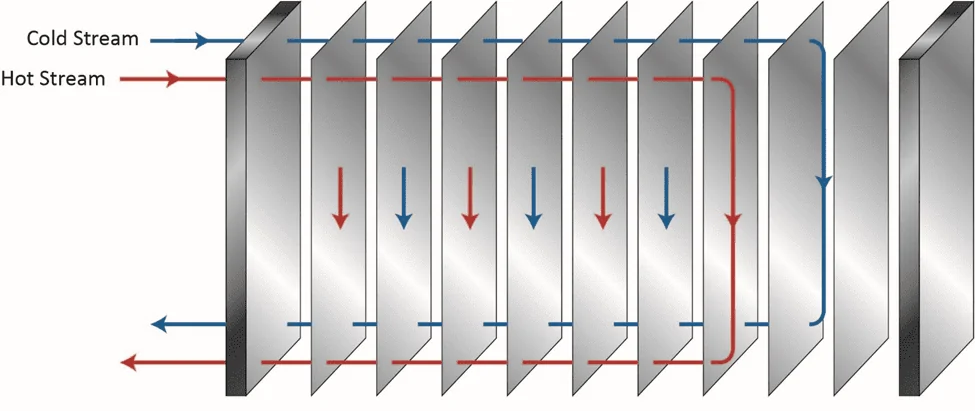
Figure 5a. Diagramme de débit de base d’un échangeur de chaleur à plaque et cadre à un seul passage.

Figure 5b.Une plaque individuelle d’un échangeur de chaleur à plaque et cadre. Partie inférieure de la plaque déjà nettoyée par jet d’eau, partie supérieure non nettoyée, présentant un encrassement qui a réduit le transfert de chaleur.
L’espacement étroit entre les plaques offre une configuration de base pour l’encrassement et le dépôt, et comme l’illustre la figure 5b, les plaques sont souvent conçues avec un motif ondulé ou similaire pour améliorer la turbulence du liquide et le transfert de chaleur. Malgré cela, l’encrassement et les dépôts ne peuvent pas être complètement entravés.
Un autre aspect très important des problèmes de corrosion/dépôt dans les échangeurs de chaleur est la surface de la paroi, également appelée la température de la peau. Bien que l’augmentation générale de la température de l’eau de refroidissement en vrac lorsque l’eau passe à travers un échangeur de chaleur puisse influencer de nombreuses réactions, des réactions supplémentaires ou plus prononcées sont possibles à la surface du métal, où les températures peuvent être considérablement plus élevées que dans l’eau en vrac. Il s’agit d’un facteur à prendre en compte lors de l’évaluation de la conception de l’échangeur de chaleur, de la métallurgie et des programmes de traitement chimique.
Les tours de refroidissement sont un autre ensemble d’échangeurs de chaleur sensibles à la corrosion, à l’entartrage et surtout à l’encrassement. La figure 6a montre le remplissage de la tour de refroidissement avec un encrassement important. Dans la Figure 6b, de longs filets d’algues pendent du remplissage à presque la cuvette de la tour de refroidissement.

Figure 6a. Remplissage encrassé du film de la tour de refroidissement.

Figure 6b.Croissance grave d’algues dans une tour de refroidissement.
Les méthodes de traitement pour contrôler les « trois grands » problèmes du triangle de la figure 1 ont été abordées par les auteurs dans un article précédent de ce journal [2]. Pour récapituler : Au milieu du siècle dernier, le chromate (CrO42-) associé à l’alimentation en acide sulfurique était très populaire pour le contrôle de la corrosion et du tartre dans de nombreux systèmes de refroidissement. Bien que le chromate soit considéré comme un inhibiteur anodique, avec une dose suffisante, il formera une couche superficielle complète de chromate de fer (acier pseudo-inoxydable), qui peut être très protectrice. L’alimentation en acide pour maintenir un pH d’eau de refroidissement dans une plage de 6,5 à 7,0 convertit une grande partie de l’alcalinité des ions bicarbonate (HCO3-) en CO2, qui s’échappe sous forme de gaz. La réduction de l’alcalinité réduit considérablement le potentiel de tartre du carbonate de calcium (CaCO3), qui est généralement le premier gisement minéral qui précipiterait autrement sans traitement. La chimie du chrome/acide est très simple et efficace; cependant, les problèmes environnementaux liés à la décharge de chrome, en particulier en ce qui concerne la toxicité du chrome hexavalent (Cr6+), ont conduit à l’abandon de cette méthode.
Le traitement a ensuite évolué vers une chimie à base de phosphate pour la prévention du tartre et de la corrosion. Ces programmes fonctionnent généralement à un pH légèrement alcalin d’environ 8,0 à 8,5, ce qui minimise la corrosion générale. La chimie fournit également une protection supplémentaire contre la corrosion, car le phosphate réagira avec les ions ferreux (Fe2+) produits aux sites anodiques pour former un dépôt limitant la réaction, tandis que le phosphate de calcium (Ca3(PO4)2) précipite dans l’environnement alcalin local aux sites cathodiques pour inhiber le transfert d’électrons. Cependant, même de petits perturbations dans les programmes de phosphate peuvent causer un grave encrassement du phosphate de calcium, et à un moment donné, le dépôt de Ca3(PO4)2 est devenu un problème presque aussi important qu’auparavant. Les méthodes de traitement ont évolué vers des méthodologies plus indulgentes, avec le phosphate organique (également connu sous le nom de phosphonate) comme base dans de nombreux cas, complété par un polymère pour le contrôle des dépôts de phosphate de calcium. Les phosphonates se fixent aux dépôts lorsqu’ils se forment et perturbent la croissance cristalline et la résistance du réseau.
Même avec ces améliorations, de nombreux problèmes demeurent avec le traitement au phosphate/phosphonate, y compris une préoccupation croissante concernant l’écoulement du phosphore dans l’environnement. Ces problèmes ont conduit à des méthodologies avancées avec la fonctionnalité de base basée sur la chimie de l’inhibiteur de l’amidon polyhydroxylé réactif (RPSI), comme illustré par, par exemple, la technologie FlexPro® de ChemTreat. En raison de nombreux sites actifs sur les molécules, ces composés se fixent au métal de base et forment une couche protectrice. Les formulations courantes de RPSI comprennent également des polymères avancés qui inhibent la formation de tartre par la modification du cristal et la séquestration des ions. La figure 7 montre le même échangeur de chaleur que la figure 2 après le nettoyage et le passage au traitement FlexPro®.

Figure 7. L’échangeur de chaleur de la Figure 2 sur la chimie FlexPro®. Les tubes sont essentiellement exempts de corrosion et de dépôt.
La plupart des programmes modernes de traitement chimique des tours de refroidissement fonctionnent dans une plage de pH légèrement basique de 8,0 à 8,5. Le gaz chlore a été le bourreau de travail pour le traitement microbiologique pendant de nombreuses années, bien que l’eau de Javel liquide (NaOCl) alimente le chlore gazeux en suspension dans de nombreuses usines pour des raisons de sécurité. Lorsque du chlore est ajouté à l’eau, la réaction suivante (Eq. (1)) se produit :
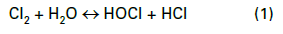
L’acide hypochloreux (HOCl) est l’agent tuant et il fonctionne en pénétrant les parois cellulaires et en oxydant les composants cellulaires internes. L’efficacité et le pouvoir tuant de ce composé sont grandement affectés par le pH en raison de la nature d’équilibre du HOCl dans l’eau, comme le montre l’Éq. (2).

L’OCl- est un biocide beaucoup plus faible que l’HOCl, probablement parce que la charge sur l’OCl-ion ne lui permet pas de pénétrer efficacement les parois cellulaires. La dissociation de l’acide hypochloreux augmente considérablement à mesure que le pH dépasse 7,5. Étant donné que de nombreux programmes de traitement de tartre/corrosion des tours de refroidissement fonctionnent à un pH alcalin, la chimie du chlore peut ne pas être le meilleur choix pour certaines applications. L’efficacité du chlore est en outre influencée par l’ammoniac et les matières organiques dans l’eau, qui réagissent de manière irréversible avec le produit chimique et augmentent la demande de chlore.
Une solution populaire à cette difficulté a été la chimie du brome, où un oxydant de chlore (le blanchiment est le choix commun) et du bromure de sodium (NaBr) sont mélangés dans un jet d’eau d’appoint et injectés dans l’eau de refroidissement. Cette chimie produit de l’acide hypobromeux (HOBr), qui a des pouvoirs de destruction similaires à ceux du HOCl, mais fonctionne plus efficacement à un pH alcalin. La figure 8 compare la dissociation du HOCl et du HOBr en fonction du pH.
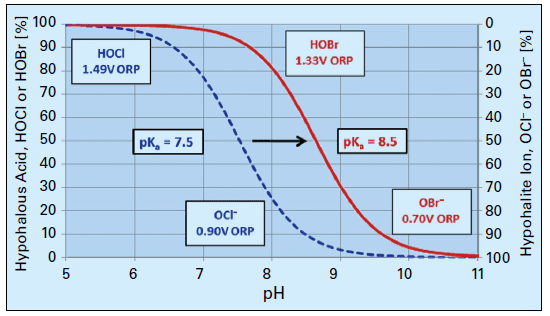
Figure 8. Dissociation du HOCl et du HOBr par rapport au pH.
De nombreuses installations telles que les raffineries, les usines chimiques, les usines d’acier et de papier, les usines d’aliments et de boissons, etc., ont souvent des systèmes de refroidissement avec des eaux contenant des matières organiques élevées, des espèces d’azote ou d’autres impuretés qui inhibent gravement la performance des oxydants conventionnels. Par conséquent, les chercheurs de ChemTreat se sont améliorés et ont développé des biocides oxydants alternatifs qui peuvent fonctionner beaucoup plus efficacement dans les eaux de refroidissement difficiles. L’un est la monochloramine (NH2Cl) avec une génération précise pour chaque application. Ce composé est un oxydant plus faible que le chlore ou le brome, mais la recherche et l’expérience opérationnelle montrent que le produit chimique est plus efficace que le chlore ou le brome pour pénétrer la couche protectrice de la slime bactérienne qui consomme des oxydants plus forts.
Une autre option est une solution spécialisée de dioxyde de chlore (ClO2). Ce composé est un oxydant sélectif, mais même s’il est à base de chlore, il ne réagit pas avec l’ammoniac et réagit moins vigoureusement avec certains produits organiques que le chlore. De plus, le composé n’est pas influencé par le pH. La production de dioxyde de chlore sur place est nécessaire, car de grandes quantités de dioxyde de chlore ne peuvent pas être stockées en toute sécurité dans des contenants ou des réservoirs. Cependant, la plupart des méthodes de production modernes comprennent plus de mesures de protection et de contrôles de sécurité que les technologies précédentes.
Pour le personnel de l’usine qui souhaite toujours utiliser de l’eau de Javel (hypochlorite de sodium), mais dont les systèmes de refroidissement font face à au moins certains des défis mentionnés ci-dessus, l’utilisation de stabilisateurs halogènes peut être un bon choix. Ces produits contiennent généralement une combinaison de stabilisateur halogène et de biopénétrant. Le premier, comme son nom l’indique, stabilise le chlore dans la solution et assure une libération contrôlée. Le biopénétrant contribue à l’efficacité du biocide en déstabilisant les couches protectrices de la slime pour permettre à l’oxydant un meilleur accès aux organismes sous-jacents.
Dans certaines plantes, l’alimentation en oxydant est limitée à deux heures par jour, ce qui donne aux microbes le temps de se déposer et de former des colonies pendant les périodes creuses. Par conséquent, un apport supplémentaire de biocide non oxydant peut-être une fois par semaine peut être très efficace pour contrôler la croissance biologique. Les non-oxydants, associés aux bio-pénétrants, réduisent l’utilisation globale de chlore et ne produisent pas de sous-produits organiques halogénés. Le tableau 1 ci-dessous énumère les propriétés de certains des non-oxydants les plus courants.
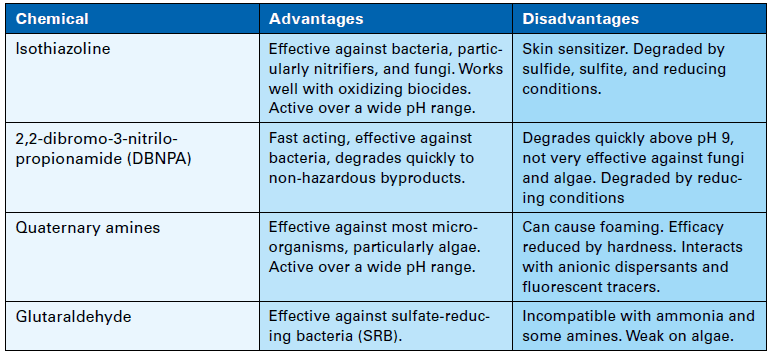
Tableau 1. Biocides non oxydants.
Une évaluation minutieuse des espèces microbiennes dans l’eau de refroidissement est nécessaire pour déterminer les biocides les plus efficaces. Les composés antimicrobiens ne doivent pas être utilisés ou même testés sans l’approbation de l’organisme de réglementation approprié. Ils doivent être intégrés au permis de décharge de l’usine. De plus, comme pour tous les produits chimiques, la sécurité est un problème absolument critique avec les biocides. Les directives relatives à la fiche signalétique (FS) doivent être suivies dans la lettre lors de la manipulation de ces produits.
De nombreuses usines ont de nombreux échangeurs de chaleur qui sont généralement intégrés dans un système d’eau de refroidissement fermé, qui rejette la chaleur dans le système de refroidissement de recirculation ouvert primaire (voir Figure 9).
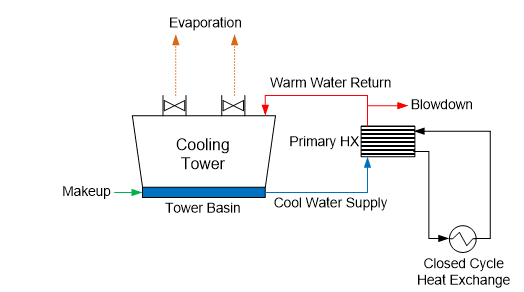
Figure 9.Schéma général d'un système de refroidissement primaire à recirculation ouverte et secondaire fermé.
Le terme « système fermé » d’eau de refroidissement est quelque peu une erreur d’identification, car pratiquement tous les systèmes présentent des fuites ou de petites pertes quelque part qui nécessitent un maquillage. (Si une corrosion grave s’est produite, ces pertes peuvent être importantes.) Les systèmes sont souvent conçus avec un réservoir à tête pour l’appoint d’eau et la gestion des changements de demande. Cet arrangement peut permettre à un peu d’oxygène de pénétrer dans l’eau de refroidissement, ce qui, bien sûr, influence le potentiel de corrosion.
Bien qu’il puisse être possible d’utiliser de l’eau avec des qualités variées dans les systèmes CCW, un choix commun, et notre principal objectif ici, est le condensat spécialement traité ou l’eau déminéralisée. Le choix du condensat plutôt que de l’eau moins pure minimise la possibilité de difficultés causées par les composés de dureté formant le tartre ou les agents corrosifs comme le chlorure et le sulfate.
Un matériau de tuyauterie typique pour les systèmes CCW est l’acier au carbone, l’acier inoxydable ou peut-être les alliages de cuivre étant un choix commun pour les tubes ou les plaques d’échangeur de chaleur dans les échangeurs à plaque et cadre. D’autres métaux peuvent inclure l’aluminium ou les métaux contenus dans la soudure des raccords dans les serpentins de refroidissement de l’échangeur de chaleur. Lors de la planification d’un programme de traitement, il est important de connaître l’ensemble de la métallurgie du système.
Les inhibiteurs de corrosion ralentissent les réactions à l’anode, à la cathode ou parfois aux deux sites des cellules électrochimiques. Une méthode de traitement très courante, basée sur le coût et la capacité à protéger l’acier au carbone, est le nitrite appliqué par injection de nitrite de sodium (NaNO2) dans le circuit de refroidissement. Lorsque l’acier au carbone est mis en service pour la première fois, la surface métallique développe une couche d’oxyde. Bien que la formation de ce revêtement d’oxyde soit un mécanisme de corrosion, la couche sert de pellicule protectrice pour le métal de base en dessous. Cependant, la couche d’oxyde naturel peut être endommagée par des influences mécaniques ou pénétrée par des agents corrosifs. Le nitrite forme un film d’oxyde de fer passivant aux anodes qui peuvent éventuellement couvrir toute la surface de l’acier. Une réaction représentative de cette chimie est décrite dans Eq. (3).

Un aspect important à noter dans cette équation est que la réaction au nitrite produit de l’ammoniac, qui peut induire la corrosion des alliages de cuivre, en particulier si un élément ou un composé oxydant comme l’oxygène est également présent dans l’eau. Le pH de ces solutions est généralement ajusté à une plage de 8,5 à 11 avec un composé alcalin comme l’hydroxyde de sodium ou l’agent tampon tétraborate de sodium, communément appelé borax.
Un concept clé en ce qui concerne les inhibiteurs anodiques comme le nitrite est que la concentration chimique ne devrait pas être inférieure à une valeur minimale. Si le niveau chute trop bas, des anodes se développeront dans ce qui est autrement un grand environnement cathodique, établissant des sites localisés pour une corrosion très intense. Des piqûres traversant la paroi peuvent en être le résultat. Une plage courante de concentration de nitrite est de 500 à 1 500 mg∙L-1. Les auteurs ont travaillé avec des systèmes de refroidissement fermés dans lesquels cette plage ne pouvait pas être maintenue en raison de fuites importantes. Le traitement a été suspendu pour protéger le reste de la tuyauterie contre la corrosion localisée. La bonne réponse à ces problèmes est la réparation et le remplacement de la tuyauterie corrodée pour remettre le système à l’état « fermé ». La direction de l’usine n’est pas toujours d’accord avec cette philosophie en raison du coût et de la complexité de la tâche. Cependant, les fuites importantes nécessitent un maquillage important. Une alimentation excessive de maquillage saturé en oxygène propage la corrosion.
L’un des inconvénients du traitement au nitrite est que le produit chimique sert de nutriment pour certaines bactéries, telles que Nitrobactera Agillis, qui convertit le nitrite en nitrate (NO3-), qui, à son tour, peut générer une substance visqueuse importante. L’auteur Brad Buecker a déjà observé un système d’eau de refroidissement fermé traité au nitrite dans une grande usine d’assemblage automobile, dans laquelle la boue microbienne restreignait le débit dans les serpentins de refroidissement de petits calibres des dispositifs de soudage automatisés. La surchauffe est devenue un problème. De plus, certains micro-organismes, par l’intermédiaire de leurs processus métaboliques, produisent des acides et d’autres sous-produits nocifs qui peuvent attaquer directement les métaux par le biais du mécanisme connu sous le nom de corrosion induite microbiologiquement (MIC).
Une autre option d’inhibiteur de corrosion, bien qu’elle soit plus coûteuse, est le molybdate (MoO42-), qui est généré par l’ajout de molybdate de sodium (Na2MoO4) à l’eau de refroidissement. Comme le chromate, le molybdate se lie au fer pour former une couche superficielle de molybdate ferreux (FeMoO4). Ce composé offre une bonne protection, en particulier contre le chlorure d’anions et le sulfate nocifs. Une plage posologique courante est de 200 à 1 000 mg∙L-1, avec une plage de pH typique recommandée de 9,0 à 11,0. Le nitrite et le chromate peuvent être mélangés pour fournir un effet synergique, où le nitrite améliore la liaison plus serrée du molybdate. Souvent, dans ces cas, la plage de contrôle de chaque produit chimique est légèrement inférieure à celle utilisée individuellement.
D’autres méthodes de protection sont disponibles, y compris la protection par les silicates, et l’utilisation d’un agent réducteur comme l’hydrazine pour maintenir la couche passive Fe3O4 (magnétite) sur l’acier au carbone et l’oxyde cupreux (Cu2O) sur les alliages de cuivre. Cependant, pour les alliages de cuivre, la chimie azolée est souvent le meilleur choix. Un membre courant du groupe azole est le tolyltriazole (TTA), dont la structure est illustrée à la figure 10.
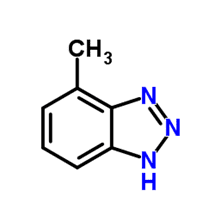
Figure 10. Structure de base de la TTA.
Lorsqu’elle est utilisée dans des solutions de base, qui sont courantes pour le nitrite et le molybdate, la molécule se déprotone (perd l’ion hydrogène) et l’azote adhère à la surface du cuivre. Les anneaux organiques du composé forment une pellicule semblable à une plaque pour protéger le métal de base.
Dans un système fermé sans charge organique, les conditions sont théoriquement défavorables pour l’encrassement microbiologique. Pourtant, comme nous l’avons déjà noté, l’encrassement peut être problématique dans certains systèmes, en particulier ceux qui utilisent une forme de produits chimiques organiques, comme les dérivés azolés ou les dispersants, qui peuvent se décomposer et fournir des aliments pour les microbes. Ajouter un nutriment comme le nitrite ou son produit de réaction, le nitrate et des problèmes importants peuvent survenir. Si le système utilise de l’eau autre que le condensat, d’autres microbes comme les bactéries sulfatées peuvent proliférer.
Par conséquent, un traitement microbiologique peut être nécessaire, mais contrairement aux systèmes de refroidissement ouverts, les biocides oxydants ne sont généralement pas utilisés dans les systèmes fermés. Les oxydants peuvent réagir avec certains inhibiteurs de corrosion comme le nitrite ou introduire des espèces corrosives, comme le chlorure, dans l’eau. Biocide non oxydant
